Bài viết có sự tham vấn chuyên môn của Tiến sĩ Trịnh Như Thùy – Giám đốc Ngân hàng mô – tế bào gốc DNA
Trong những năm gần đây, liệu pháp tế bào gốc đã nổi lên như một phương pháp đầy hứa hẹn, mang đến hy vọng mới cho người bệnh trong việc phục hồi chức năng sau đột quỵ.

Đột quỵ – căn bệnh nguy hiểm có thể gây tàn phế
Đột quỵ, một bệnh lý cấp tính nguy hiểm, là nguyên nhân tử vong phổ biến thứ hai, đứng đầu trong các nguyên nhân gây tàn phế trên toàn cầu và là một thách thức lớn đối với y học hiện đại. Tại Việt Nam, mỗi năm có khoảng 200.000 người bị đột quỵ. Trung bình cứ 6 người thì có 1 người có nguy cơ đột quỵ.
Theo Boehme và cộng sự (2017) [1], cứ ba người bị đột quỵ thì có một người phải đối mặt với các rối loạn chức năng và thần kinh sau sự cố. Hầu hết các ca đột quỵ (hơn 80%) là đột quỵ do thiếu máu cục bộ, thường xảy ra do tắc nghẽn động mạch não giữa [2]…
Nguyên nhân, các yếu tố nguy cơ và di chứng sau đột quỵ
Đột quỵ là hậu quả do mất nguồn cung cấp máu lên não (thiếu máu cục bộ) hoặc chảy máu trong não (xuất huyết não), với các yếu tố nguy cơ bao gồm:
- Tuổi cao và giới tính (nam giới có nguy cơ cao hơn).
- Bệnh lý mãn tính như tăng huyết áp, tiểu đường và bệnh tim.
- Thói quen sống không lành mạnh như hút thuốc, uống rượu quá mức, lười vận động và ăn uống không khoa học chẳng hạn như ăn quá nhiều thực phẩm chế biến sẵn hoặc thiếu rau củ quả.
- Các yếu tố di truyền cũng đóng vai trò đáng kể trong nguy cơ mắc bệnh.
Tùy thuộc vào mức độ nghiêm trọng, đột quỵ có thể gây ra các hậu quả như: liệt nửa người, suy giảm nhận thức, rối loạn ngôn ngữ, và mất khả năng tự chủ trong sinh hoạt. Hiện nay, mặc dù y học đã có những tiến bộ đáng kể trong điều trị đột quỵ, bao gồm thuốc men và các phương pháp phục hồi chức năng, nhưng hiện tại chưa có phương pháp nào được xem là “chữa khỏi” hoàn toàn. Việc điều trị chủ yếu chỉ tập trung vào phục hồi sau tổn thương, nhưng khả năng tái tạo mô não vẫn còn hạn chế.
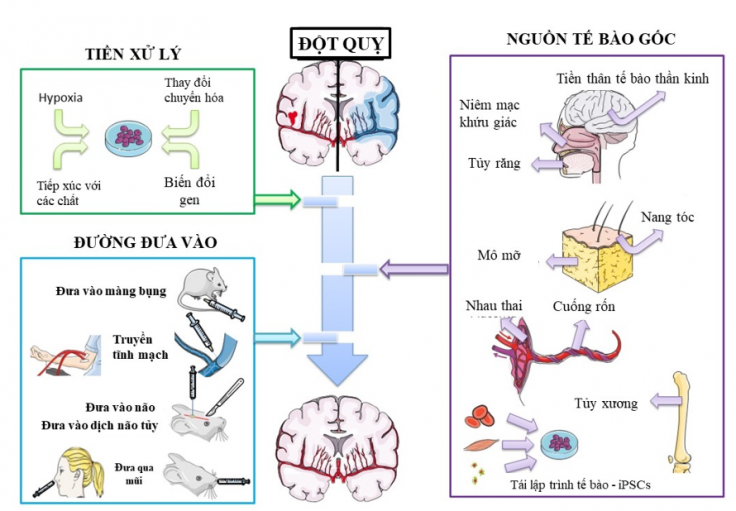
Liệu pháp tế bào gốc cho đột quỵ là một phương pháp điều trị mới đầy hứa hẹn giúp người bệnh phục hồi sau những ảnh hưởng nghiêm trọng của đột quỵ. Dựa trên cơ chế thay thế các mô não bị tổn thương và phục hồi chức năng đã mất, phương pháp này đang được nghiên cứu và ứng dụng trong thực tiễn với những kết quả đáng khích lệ.
Tế bào gốc và cơ chế tác động
Tế bào gốc, đặc biệt là tế bào gốc trung mô (Mesenchymal Stem Cells, MSCs), được xem như một công cụ tiềm năng trong phục hồi sau đột quỵ nhờ khả năng tái tạo và sửa chữa tổn thương.
Tế bào gốc trung mô nhận được sự chú ý lớn nhờ khả năng biệt hóa thành tế bào thần kinh và hỗ trợ điều trị các loại đột quỵ, bao gồm cả đột quỵ thiếu máu cục bộ và xuất huyết não. MSCs có thể được thu nhận từ nhiều nguồn như: tủy xương, mô mỡ, mô cuống rốn. Khác với tế bào gốc phôi (Embryonic Stem Cells), MSCs dễ thu thập, ít gây tranh cãi về đạo đức và không bị cơ thể thải ghép khi sử dụng từ chính bệnh nhân [3].
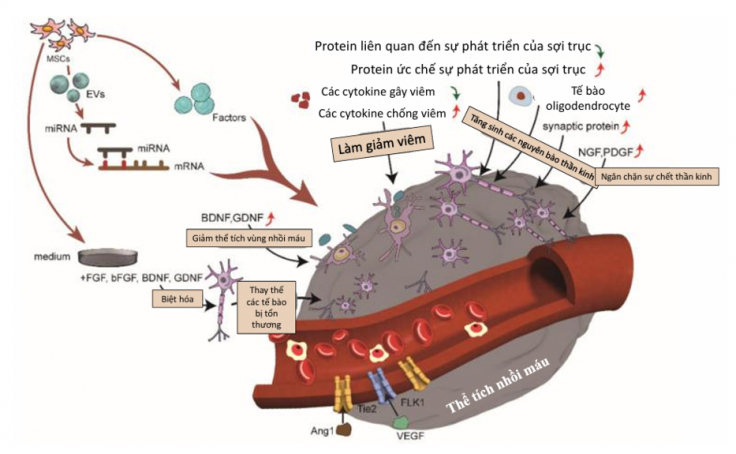
– Giảm viêm thông qua điều hòa miễn dịch
Sau khi xảy ra đột quỵ, các tế bào miễn dịch như tế bào vi thần kinh đệm (microglia) bị kích hoạt, sản sinh ra các chất gây viêm mạnh [4]. MSCs giúp:
- Tăng các cytokine chống viêm (IL-4, IL-10, TNF-β).
- Giảm các cytokine gây viêm (IL-1, TNF-α, IFN-γ).
- Ức chế các yếu tố viêm muộn như HMGB1(là yếu tố gây viêm kéo dài và tổn thương thêm).
Nhờ đó, MSCs làm giảm phản ứng viêm trong não và hỗ trợ sửa chữa tổn thương.
Dựa trên một số lượng lớn các nghiên cứu trên động vật về đột quỵ, ngày càng có nhiều sự quan tâm đến tiềm năng chống viêm của MSCs trong điều trị các bệnh thần kinh viêm. Người ta đã phát hiện ra rằng MSCs có thể điều chỉnh phản ứng miễn dịch để thực hiện chức năng chống viêm, bằng cách tiết ra nhiều yếu tố miễn dịch khác nhau và các cơ chế điều chỉnh này có thể được sử dụng như các phương pháp điều trị tiềm năng. Các cơ chế ức chế viêm này sẽ rất quan trọng đối với các nghiên cứu trong tương lai nhằm cải thiện hiệu quả của các liệu pháp dựa trên MSCs đối với các bệnh thần kinh.
– Kích thích yếu tố dinh dưỡng để tăng hiệu quả điều trị
MSCs tiết ra hoặc kích thích các yếu tố dinh dưỡng quan trọng như:
- BDNF & GDNF: Giảm kích thước vùng tổn thương và bảo vệ tế bào thần kinh.
- VEGF: Tăng sinh mạch máu.
- NGF & PDGF: Kích thích tái tạo nơron và ức chế quá trình chết tế bào.
Nghiên cứu cho thấy hiệu quả điều trị của MSCs phụ thuộc vào số lần cấy chuyền và nguồn gốc tế bào. MSCs giai đoạn cấy chuyền sớm (earlier passage) tiết nhiều yếu tố dinh dưỡng và mang lại hiệu quả tái tạo thần kinh tốt hơn so với giai đoạn muộn (later passage). Đồng thời, MSCs từ mô mỡ (ADSCs) tiết VEGF cao hơn MSCs từ tủy xương (BMSCs), hỗ trợ tái tạo mạch máu và mô thần kinh hiệu quả hơn [5].
– Thúc đẩy hình thành mạch máu mới (Angiogenesis)
Sau khi được cấy ghép, MSCs tiết ra các yếu tố như VEGF và Ang1, tăng mật độ mạch máu và cải thiện lưu lượng máu cục bộ [6]. Một số nghiên cứu sử dụng MSCs chỉnh sửa gen để tăng biểu hiện các yếu tố này, mang lại hiệu quả tái tạo mạnh mẽ hơn. Việc tái tạo mạch máu trong não rất quan trọng đối với bệnh nhân đột quỵ, vì vậy cần nghiên cứu kỹ lưỡng các cơ chế liên quan để ngăn ngừa tình trạng bệnh của bệnh nhân trầm trọng hơn và các hậu quả bất lợi khác trong tương lai.
– Kích thích tái tạo Nơ-ron (Neurogenesis)
Hai cách mà cấy ghép MSCs có thể thúc đẩy quá trình sinh thần kinh là:
- Tăng sinh nơron nội sinh: Các tế bào thần kinh ở vùng ranh giới tổn thương được kích thích phát triển [7].
- Tăng cường kết nối thần kinh: Hỗ trợ phát triển sợi trục, synapse và bao myelin [8].
Ngoài ra, MSCs còn bảo vệ các tế bào thần kinh đang phát triển mới khỏi môi trường gây bệnh, giúp giảm mất mát nơron [9].
Thúc đẩy quá trình sinh thần kinh là một cơ chế quan trọng đối với liệu pháp MSCs, giúp bệnh nhân phục hồi sau đột quỵ thông qua việc sửa chữa các vị trí bị tổn thương. Tuy nhiên, do khả năng tái tạo hạn chế của tế bào gốc thần kinh (NSC) và môi trường sinh lý phức tạp, hiệu quả sửa chữa của chúng không lý tưởng. Vì lý do đó, MSC có thể được sử dụng để thúc đẩy quá trình biệt hóa của NSC thành tế bào thần kinh bằng cách sản xuất các loại yếu tố dinh dưỡng và phân tử chống apoptosis khác nhau.
– Giảm kích thước vùng tổn thương
MSC từ các nguồn như mô mỡ (ADSCs), tủy xương (BMSCs) hay dây rốn (UC-MSCs) đều được chứng minh giúp giảm diện tích vùng nhồi máu trong mô hình động vật [7].
Đặc biệt, kết hợp liệu pháp MSCs với chất hoạt hóa plasminogen mô tái tổ hợp (rtPA) có thể tăng hiệu quả điều trị và giảm biến chứng. Trên thực tế, thể tích nhồi máu ở chuột xuất huyết não được điều trị bằng cả MSC tiêm tĩnh mạch và rtPA đã giảm đáng kể so với hai phương pháp điều trị riêng lẻ. Nếu xảy ra biến chứng chảy máu sau khi điều trị bằng rtPA tiêm tĩnh mạch, MSC có thể ức chế rối loạn chức năng nội mô, do đó ức chế các biến cố chảy máu và thúc đẩy cải thiện kết quả chức năng [10].
– Thay thế tế bào tổn thương
Trong nhiều thập kỷ, các nghiên cứu đã chỉ ra rằng MSC có khả năng tái tạo mô não nhờ phân hóa thành tế bào thần kinh và tế bào thần kinh đệm trong điều kiện thích hợp.
Quá trình này yêu cầu MSCs biểu hiện nestin và có sự tương tác tế bào – tế bào trực tiếp giữa MSCs với tế bào thần kinh để tích hợp tín hiệu ngoại bào [11].
Các nghiên cứu đã chứng minh MSCs có thể tạo ra neurosphere khi được nuôi cấy trong môi trường chứa EGF và bFGF, sau đó phân hóa thành tế bào thần kinh (biểu hiện Tuj-1, NSE, MAP2, NeuN) hoặc tế bào thần kinh đệm (biểu hiện GFAP, CNPase) khi bổ sung các yếu tố tăng trưởng thần kinh như BDNF và GDNF [12]. Hiện tại, các nghiên cứu tiếp tục cải tiến môi trường nuôi cấy để nâng cao hiệu quả phân hóa, mở ra tiềm năng tái tạo mô não từ MSCs.
– Vai trò của các túi tiết ngoại bào (EVs, exosomes)
Dựa trên cơ chế cận tiết của MSCs, EVs và exosomes có thông tin điều hòa di truyền có thể được MSCs tiết ra, trở thành một chiến lược mới cho liệu pháp không tế bào. So với EV của tế bào tiền thân thần kinh, EVs và exosomes của MSCs có hiệu quả điều trị tốt hơn [13]. Thể ngoại bào từ MSCs, đặc biệt là exosome, mang theo protein và microRNA giúp: Giảm viêm, giảm thể tích nhồi máu và tổn thương tế bào thần kinh, tăng sinh mạch máu mới và tái tạo thần kinh.
Liệu pháp này đang được phát triển như một lựa chọn “không dùng tế bào,” an toàn hơn và ít gây phản ứng miễn dịch.
Kết luận
Liệu pháp tế bào gốc, đặc biệt là tế bào gốc trung mô (MSCs), đã và đang mở ra những triển vọng to lớn trong điều trị và phục hồi chức năng sau đột quỵ. Với khả năng điều hòa miễn dịch, giảm viêm, kích thích tái tạo mạch máu và thần kinh, thay thế các tế bào tổn thương, cũng như sử dụng túi tiết ngoại bào (EVs, exosomes) để truyền tải yếu tố điều trị, MSCs không chỉ mang lại hy vọng cho bệnh nhân mà còn tạo động lực thúc đẩy các nghiên cứu lâm sàng.
Dù vậy, vẫn cần thêm nhiều nghiên cứu để tối ưu hóa phương pháp cấy ghép, cải thiện hiệu quả biệt hóa, cũng như đảm bảo tính an toàn và bền vững của liệu pháp này. Với những tiến bộ không ngừng, tế bào gốc hứa hẹn sẽ trở thành một phương pháp điều trị tiên tiến và toàn diện, giúp hàng triệu bệnh nhân đột quỵ trên thế giới tìm lại cơ hội sống khỏe mạnh và phục hồi chức năng.
- Boehme, A.K., C. Esenwa, and M.S. Elkind, Stroke risk factors, genetics, and prevention. Circulation research, 2017. 120(3): p. 472-495.
- Kuriakose, D. and Z. Xiao, Pathophysiology and treatment of stroke: present status and future perspectives. International journal of molecular sciences, 2020. 21(20): p. 7609.
- Zhang, Y., et al., Mesenchymal Stem Cells: Therapeutic Mechanisms for Stroke. Int J Mol Sci, 2022. 23(5).
- Levard, D., et al., Filling the gaps on stroke research: Focus on inflammation and immunity. Brain, behavior, and immunity, 2021. 91: p. 649-667.
- Ikegame, Y., et al., Comparison of mesenchymal stem cells from adipose tissue and bone marrow for ischemic stroke therapy. Cytotherapy, 2011. 13(6): p. 675-685.
- Zacharek, A., et al., Angiopoietin1/Tie2 and VEGF/Flk1 induced by MSC treatment amplifies angiogenesis and vascular stabilization after stroke. Journal of Cerebral Blood Flow & Metabolism, 2007. 27(10): p. 1684-1691.
- Noh, J.-E., et al., Intracerebral transplants of GMP-grade human umbilical cord-derived mesenchymal stromal cells effectively treat subacute-phase ischemic stroke in a rodent model. Frontiers in Cellular Neuroscience, 2020. 14: p. 546659.
- Yan, T., et al., Neurorestorative responses to delayed human mesenchymal stromal cells treatment of stroke in type 2 diabetic rats. Stroke, 2016. 47(11): p. 2850-2858.
- He, J., et al., MSC spheroids-loaded collagen hydrogels simultaneously promote neuronal differentiation and suppress inflammatory reaction through PI3K-Akt signaling pathway. Biomaterials, 2021. 265: p. 120448.
- Nakazaki, M., et al., Intravenous infusion of mesenchymal stem cells inhibits intracranial hemorrhage after recombinant tissue plasminogen activator therapy for transient middle cerebral artery occlusion in rats. Journal of Neurosurgery, 2017. 127(4): p. 917-926.
- Wislet‐Gendebien, S., et al., Plasticity of cultured mesenchymal stem cells: Switch from nestin‐positive to excitable neuron‐like phenotype. Stem cells, 2005. 23(3): p. 392-402.
- Alizadeh, R., et al., Differentiation of human mesenchymal stem cells (MSC) to dopaminergic neurons: A comparison between Wharton’s Jelly and olfactory mucosa as sources of MSCs. Journal of chemical neuroanatomy, 2019. 96: p. 126-133.
- Zheng, X., et al., Extracellular vesicles derived from neural progenitor cells––a preclinical evaluation for stroke treatment in mice. Translational stroke research, 2021. 12: p. 185-203.
- Valeri, A. and E. Mazzon, State of the Art and Future of Stem Cell Therapy in Ischemic Stroke: Why Don’t We Focus on Their Administration? Bioengineering, 2023. 10(1): p. 118.