Bài viết có sự tham vấn chuyên môn của Tiến sĩ Trịnh Như Thùy – Giám đốc Ngân hàng mô tại Bệnh viện Quốc tế DNA.
Tế bào gốc trung mô đang thu hút sự quan tâm nhờ khả năng điều hòa miễn dịch và điều chỉnh môi trường viêm nhiễm trong cơ thể, giúp hỗ trợ điều trị hội chứng chuyển hóa.

1. Giới thiệu chung
Hội chứng chuyển hóa, yếu tố nguy cơ và điều trị hiện tại
Bệnh tiểu đường và béo phì đã trở thành vấn đề toàn cầu trong vài thập kỷ qua, dẫn đến sự gia tăng các trường hợp mắc Hội chứng chuyển hóa (Metabolic Syndrome, MetS). MetS ảnh hưởng đến khoảng 25% người lớn trên toàn thế giới, làm tăng gấp đôi nguy cơ mắc bệnh tim mạch và tăng gấp năm lần khả năng phát triển đái tháo đường típ 2. MetS là tập hợp các tình trạng bao gồm béo phì vùng bụng, tăng huyết áp, tăng đường huyết hoặc kháng insulin, và rối loạn lipid máu (tăng triglyceride hoặc giảm HDL cholesterol). Một người được chẩn đoán MetS khi có từ ba triệu chứng này trở lên. Nguyên nhân gây MetS bao gồm lối sống ít vận động, chế độ ăn uống không lành mạnh, hút thuốc, địa vị kinh tế xã hội cao, và di truyền [1,2].
MetS gây ra tổn thương mãn tính qua viêm nhẹ trong cơ thể. Các đặc điểm sinh lý của MetS là kháng insulin, tích mỡ bụng, rối loạn lipid máu xơ vữa, rối loạn mạch máu, tăng huyết áp, tình trạng dễ đông máu, và căng thẳng mãn tính [3].
Ảnh hưởng của béo phì và đường huyết cao
Béo phì làm tăng tiết các chất chuyển hóa mỡ như glycerol, acid béo tự do (FFA), và cytokine gây viêm (TNF-α, IL-6), cùng các yếu tố khác gây ảnh hưởng đến chức năng điều hòa của insulin [2,3]. Insulin và con đường PI3K-Akt bị ảnh hưởng, dẫn đến tình trạng viêm và kháng insulin trong đái tháo đường típ 2. Tương tự, đường huyết cao do tế bào β bị tổn thương hoặc mất đi khả năng tiết insulin gây ảnh hưởng đến nhiều chức năng của cơ thể, đặc biệt là các mô cần glucose như cơ xương [1]. Những thay đổi sinh lý này cũng góp phần gây ra tăng huyết áp, một triệu chứng phổ biến ở người béo phì và không dung nạp glucose [3].
Các phương pháp điều trị hiện tại
Hiện nay, phương pháp điều trị lâm sàng cho bệnh tiểu đường chủ yếu sử dụng thuốc uống chống tiểu đường và tiêm insulin thường xuyên, nhưng các liệu pháp này chưa phục hồi hoàn toàn khả năng tiết insulin hoặc kháng insulin lâu dài. Mặc dù việc ghép tạng hoặc mô tuyến tụy được coi là có triển vọng, nhưng các thủ thuật này đòi hỏi phải sàng lọc người hiến tặng rộng rãi, khả năng đào thải ghép và nguy cơ phải trải qua các thủ thuật xâm lấn. Tương tự, các loại thuốc điều trị tăng huyết áp như giãn mạch, prostacyclin, và thuốc chống đông máu thường không duy trì được huyết áp ở mức bình thường [4].
Tế bào gốc trung mô (MSC)
Nghiên cứu cho thấy tế bào gốc trung mô (MSC) có thể đóng vai trò là giải pháp khả thi cho những hạn chế của các liệu pháp hiện tại nhờ khả năng tiết các chất điều hòa miễn dịch, chống viêm và các yếu tố bảo vệ tế bào [5]. MSCs có thể biệt hóa thành nhiều loại tế bào khác và có đặc tính miễn dịch mạnh, ức chế hoạt động của tế bào T và B, giúp ích trong điều trị các bệnh suy thoái và tự miễn. MSC có thể được thu từ nhiều nguồn khác nhau, bao gồm tủy xương, mô mỡ, dây rốn, và các nguồn mô khác. Đặc biệt, MSC từ Wharton’s Jelly (WJ-MSC) của cuống rốn có tiềm năng điều trị cao do khả năng tăng sinh mạnh và ít rủi ro. Việc lấy WJ-MSC từ mô cuống rốn là một quy trình không xâm lấn, tận dụng phần dây rốn bỏ đi sau sinh mà không gây đau đớn hay ảnh hưởng đến sức khỏe của cả mẹ và bé. Quy trình thu thập này không đòi hỏi bất kỳ can thiệp nào vào cơ thể người mẹ trong suốt thời kỳ mang thai hay lúc sinh, đảm bảo an toàn tuyệt đối. Nhờ vậy, WJ-MSC không chỉ mang lại tiềm năng điều trị vượt trội mà còn không gây nguy hiểm, là nguồn tế bào gốc dễ dàng thu nhận và có tính ứng dụng cao trong điều trị lâm sàng [6].
MSC và các yếu tố tiết ra của chúng đã thể hiện hiệu quả cao trong điều trị nhiều bệnh, và hiện đang được xem xét cho điều trị MetS và các bệnh liên quan.
2. Cơ chế điều trị của tế bào gốc cho người bị rối loạn chuyển hóa
Tế bào gốc trung mô đang thu hút sự quan tâm nhờ khả năng điều hòa miễn dịch và điều chỉnh môi trường viêm nhiễm trong cơ thể, giúp hỗ trợ điều trị hội chứng chuyển hóa. MSCs có khả năng biệt hóa thành các loại tế bào như tế bào mỡ, xương, và sụn,… cũng như tác động đến môi trường mô đích thông qua các yếu tố tín hiệu cận tiết (paracrine signaling). Cơ chế chính bao gồm:
- Phục hồi chức năng tế bào β: MSC giúp tái sinh tế bào β ở tụy, hỗ trợ giảm đường huyết bằng cách tiết các yếu tố sinh học cần thiết để thúc đẩy môi trường phục hồi và ức chế phản ứng miễn dịch qua trung gian tế bào T.
- Điều chỉnh môi trường viêm và chống oxy hóa: MSC tiết các cytokine chống viêm, điều chỉnh tình trạng viêm toàn thân, và kích thích tái sinh các mô tổn thương.
- Tái tạo hệ mạch và cấu trúc tim phổi: MSC giảm dày lên của tiểu động mạch phổi, cải thiện áp lực máu và cấu trúc thất phải, hỗ trợ trong các bệnh lý tim mạch và phổi liên quan đến MetS.
- Cân bằng adipokine:
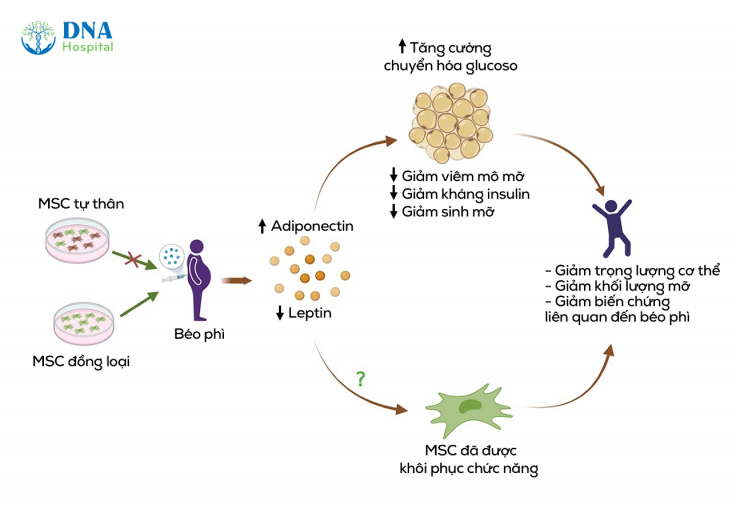
Tế bào gốc tự thân và đồng loại đều có thể được sử dụng trong liệu pháp MSC để chống lại béo phì và các biến chứng liên quan; tuy nhiên, MSC từ mô mỡ của người béo phì có thể không hiệu quả về mặt điều trị do tiềm năng bị suy giảm. Trong số các lợi ích khác nhau, điều trị bằng MSC giúp tăng adiponectin và giảm leptin, qua đó tái lập sự cân bằng của các adipokine ở các đối tượng bị béo phì. Vì adipokine có nhiều tác động lên viêm, chuyển hóa và tiêu hao năng lượng, nên việc bình thường hóa các adipokine trong huyết thanh được cho là sẽ góp phần vào các lợi ích điều trị khác của MSC, bao gồm cải thiện quá trình chuyển hóa glucose và lipid, giảm sinh mỡ, cải thiện tình trạng viêm mô mỡ và tái cấu trúc, cũng như ngăn ngừa các biến chứng chuyển hóa do béo phì gây ra. Hơn nữa, việc khôi phục lại mức adipokine có thể tác động tích cực đến MSC, giúp chúng khôi phục các chức năng bình thường vốn có, từ đó có thể đảo ngược quá trình tiến triển của béo phì [7].
3. Những trường hợp điều trị có hiệu quả
Nhiều nghiên cứu đã cho thấy MSC có hiệu quả tích cực trong điều trị các biểu hiện của MetS, bao gồm:
– Bệnh đái tháo đường:
- Bệnh đái tháo đường típ 1 và típ 2: MSC giúp cải thiện tình trạng đường huyết, làm giảm các triệu chứng và hỗ trợ tái sinh các tế bào β ở tụy, đặc biệt là trên các mô hình động vật bị tiểu đường [8].
- Tăng huyết áp động mạch phổi và bệnh tim mạch: MSC có tác dụng làm giảm huyết áp phổi, tái cấu trúc tim phổi và giảm viêm, giúp giảm thiểu các triệu chứng suy tim và tổn thương phổi [8].
- Bệnh lý thận và cơ tim do đái tháo đường: MSC hỗ trợ giảm viêm tại chỗ và tổn thương mô, cải thiện chức năng thận và tim trong các bệnh biến chứng của đái tháo đường [8].
Ngoài các trường hợp liên quan đến tiểu đường và bệnh lý tim mạch, các nghiên cứu cũng chỉ ra rằng MSC có hiệu quả trong việc điều trị các triệu chứng khác của hội chứng chuyển hóa, bao gồm:
– Mỡ máu cao (Rối loạn lipid máu):
MSC có tác dụng làm giảm mức cholesterol và triglyceride trong máu. Cơ chế này có thể thông qua khả năng điều hòa lipid và giảm viêm của MSC, hỗ trợ giảm nguy cơ xơ vữa động mạch và các biến chứng tim mạch. Nghiên cứu cũng cho thấy MSC có khả năng điều chỉnh chức năng gan, giúp giảm sản xuất lipid ở gan và góp phần duy trì cân bằng lipid trong cơ thể [9].
– Béo phì và tích tụ mỡ bụng:
MSC giúp điều chỉnh chuyển hóa chất béo và giảm viêm mô mỡ, góp phần ngăn ngừa hoặc giảm tích tụ mỡ thừa, đặc biệt là ở bụng. Các nghiên cứu trên mô hình động vật cho thấy MSC có thể tác động đến các tế bào mỡ, giúp giảm sự tích trữ mỡ, đồng thời kích thích tiêu thụ năng lượng trong các mô. Bằng cách tiết ra các yếu tố sinh học hỗ trợ chuyển hóa, MSC có thể hỗ trợ quá trình giảm cân và cải thiện các triệu chứng của béo phì [7].
Hội chứng chuyển hóa (MetS) là một tình trạng bệnh lý phức tạp và đang trở thành mối đe dọa toàn cầu. Các phương pháp y học hiện tại chưa thể đưa ra giải pháp triệt để do cơ chế bệnh lý của MetS còn phức tạp và chưa rõ ràng. MSC được đánh giá là lựa chọn tiềm năng trong điều trị MetS, với kết quả tích cực về độ an toàn và hiệu quả. Các nghiên cứu cho thấy MSC có khả năng cải thiện các vấn đề trong MetS như giúp giảm béo bụng, tăng đường huyết, tăng triglyceride và cao huyết áp, là phương pháp thay thế hứa hẹn cho liệu pháp truyền thống. Và cũng từ phân tích và đánh giá các công trình nghiên cứu gần đây, nguồn MSC tối ưu nhất được xác định là từ dây rốn (UC-MSC), nơi các tế bào có thể được lấy một cách thuận tiện, không xâm lấn và có đặc tính tái tạo và ức chế miễn dịch tuyệt vời.
- Xiao N, Zhao X, Luo P, Guo J, Zhao Q, Lu G, Cheng L. Co-transplantation of mesenchymal stromal cells and cord blood cells in treatment of diabetes. Cytotherapy. 2013;15:1374–1384.
- Chan AML, Ng AMH, Mohd Yunus MH, Idrus RBH, Law JX, Yazid MD, Chin KY, Shamsuddin SA, Lokanathan Y. Recent developments in rodent models of high-fructose diet-induced metabolic syndrome: a systematic review. Nutrients. 2021;13:2497.
- Bhansali S, Kumar V, Saikia UN, Medhi B, Jha V, Bhansali A, Dutta P. Effect of mesenchymal stem cells transplantation on glycaemic profile & their localization in streptozotocin induced diabetic Wistar rats. Indian J Med Res. 2015;142:63–71.
- Zhou Y, Hu Q, Chen F, Zhang J, Guo J, Wang H, Gu J, Ma L, Ho G. Human umbilical cord matrix-derived stem cells exert trophic effects on β-cell survival in diabetic rats and isolated islets. Dis Model Mech. 2015;8:1625–1633.
- Murai N, Ohtaki H, Watanabe J, Xu Z, Sasaki S, Yagura K, Shioda S, Nagasaka S, Honda K, Izumizaki M. Intrapancreatic injection of human bone marrow-derived mesenchymal stem/stromal cells alleviates hyperglycemia and modulates the macrophage state in streptozotocin-induced type 1 diabetic mice. PLoS One. 2017;12:e0186637.
- Lee H, Lee JC, Kwon JH, Kim KC, Cho MS, Yang YS, Oh W, Choi SJ, Seo ES, Lee SJ. The effect of umbilical cord blood derived mesenchymal stem cells in monocrotaline-induced pulmonary artery hypertension rats. J Korean Med Sci. 2015;30:576–585
- Pham, Duc-Vinh, Thi-Kem Nguyen, and Pil-Hoon Park. “Adipokines at the crossroads of obesity and mesenchymal stem cell therapy.” Experimental & Molecular Medicine 55.2 (2023): 313-324.
- Li Y, Zhao L, Yu D, Wang Z, Ding G. Metabolic syndrome prevalence and its risk factors among adults in China: a nationally representative cross-sectional study. PLoS One. 2018;13:e0199293.
- Xue, B., et al., Mesenchymal stem cells modified by FGF21 and GLP1 ameliorate lipid metabolism while reducing blood glucose in type 2 diabetic mice. Stem Cell Research & Therapy, 2021. 12(1): p. 133.
- Kim, B., et al., Mesenchymal Stem Cell-Derived Exosomes Attenuate Hepatic Steatosis and Insulin Resistance in Diet-Induced Obese Mice by Activating the FGF21-Adiponectin Axis. International Journal of Molecular Sciences, 2024. 25(19): p. 10447.











