Bài viết có sự tham vấn chuyên môn của Tiến sĩ Trịnh Như Thùy – Giám đốc Ngân hàng mô – tế bào gốc DNA
Liệu pháp tế bào gốc đã xuất hiện như một phương pháp mới, mang đến hy vọng cải thiện các tổn thương do đột quỵ gây ra. Dưới đây là các kết quả ứng dụng tế bào gốc trong điều trị đột quỵ.
Giới thiệu
Đột quỵ là một trong những nguyên nhân hàng đầu gây tử vong và tàn tật trên toàn cầu, ảnh hưởng nghiêm trọng đến chất lượng cuộc sống của người bệnh. Đột quỵ thiếu máu cục bộ, chiếm hơn 80% các trường hợp, xảy ra khi dòng máu cung cấp cho não bị gián đoạn, thường do tắc nghẽn động mạch não giữa. Điều này dẫn đến tổn thương mô não không thể phục hồi nếu không được can thiệp kịp thời.
Hiện nay, các phương pháp điều trị chủ yếu như sử dụng thuốc tan huyết khối và phẫu thuật thường gặp hạn chế về hiệu quả và tiềm ẩn nhiều nguy cơ. Trong bối cảnh đó, liệu pháp tế bào gốc đã xuất hiện như một phương pháp mới, mang đến hy vọng cải thiện các tổn thương do đột quỵ gây ra. Tế bào gốc không chỉ có khả năng tái tạo mô tổn thương mà còn bảo vệ tế bào thần kinh, điều hòa miễn dịch, và giảm viêm, mở ra những triển vọng mới trong điều trị bệnh lý phức tạp này.
Các cách tiếp cận trong nghiên cứu và điều trị đột quỵ thiếu máu cục bộ
1. Tế bào gốc phôi (ESCs)
Tế bào gốc phôi (ESCs) có khả năng tự làm mới vô hạn và phân biệt thành hầu hết các loại tế bào. ESCs có thể được biệt hóa thành dòng tế bào thần kinh trong điều kiện nuôi cấy đặc biệt, giúp phục hồi chức năng và cải thiện cấu trúc não bị tổn thương sau đột quỵ thiếu máu cục bộ. Tuy nhiên, ESCs dễ gây hình thành u quái (teratoma) và biến đổi ác tính, cùng với các vấn đề đạo đức và hạn chế nguồn cung. Nghiên cứu đang tập trung vào việc sử dụng các dẫn xuất thần kinh từ ESCs để giảm nguy cơ này. Ví dụ, tế bào gốc thần kinh (NSCs) biệt hóa từ ESCs đã cải thiện chức năng và thúc đẩy tái tạo mạch máu trong mô não bị tổn thương.
2. Tế bào gốc vạn năng cảm ứng (iPSCs)
iPSCs được tạo ra từ tế bào trưởng thành bằng cách lập trình lại gene, mang đặc tính tương tự ESCs nhưng không vướng phải vấn đề đạo đức. iPSCs có tiềm năng phân biệt thành tế bào thần kinh và giảm viêm trong não bị thiếu máu. Tuy nhiên, chúng cũng tiềm ẩn nguy cơ gây u quái. Nếu kiểm soát tốt tính sinh u, iPSCs là ứng viên tiềm năng cho điều trị đột quỵ.
3. Tế bào gốc thần kinh (NSCs)
NSCs có mặt tự nhiên trong não và có khả năng di chuyển đến vùng tổn thương sau đột quỵ để thúc đẩy sửa chữa mô. Tuy nhiên, số lượng NSCs nội sinh thường không đủ để phục hồi hoàn toàn. Việc cấy ghép NSCs giúp tăng khả năng hình thành tế bào thần kinh mới, giảm viêm và cải thiện chức năng thần kinh. NSCs còn có thể được biến đổi gen để tăng cường khả năng tạo mạch và bảo vệ tế bào thần kinh.
4. Tế bào gốc trung mô (MSCs)
MSCs nổi bật nhờ cơ chế điều hòa miễn dịch và tiết các yếu tố cận tiết (paracrine) thay vì thay thế tế bào. Chúng có thể giảm tổn thương hàng rào máu não, thúc đẩy tái tạo mạch máu và thần kinh, đồng thời điều hòa viêm. Nghiên cứu đã chỉ ra rằng MSCs biến đổi gen để tiết các yếu tố tăng trưởng như BDNF và VEGF giúp cải thiện chức năng thần kinh tốt hơn so với MSCs thông thường.
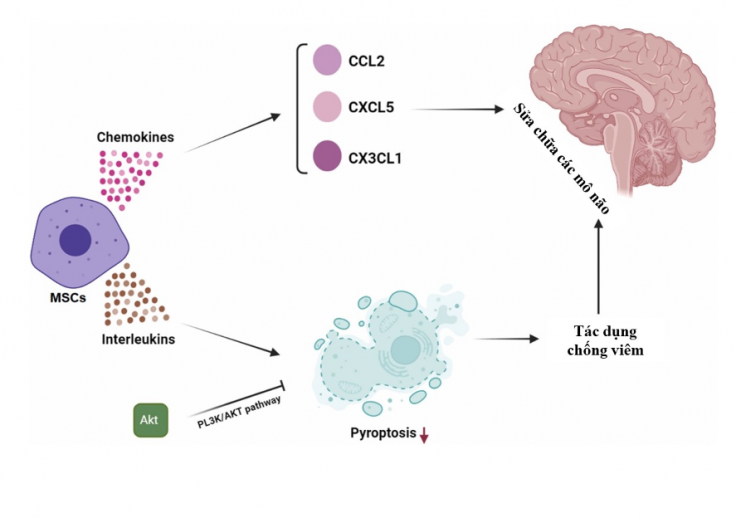
5. Liệu pháp gen dựa trên tế bào gốc
Liệu pháp này sử dụng tế bào gốc biến đổi gen để tăng cường tiết các yếu tố dinh dưỡng thần kinh (như BDNF, VEGF, EPO) nhằm thúc đẩy tái tạo và phục hồi chức năng. Đây là hướng điều trị tiềm năng trong tương lai cho bệnh nhân đột quỵ thiếu máu cục bộ.
Tổng hợp các kết quả thử nghiệm lâm sàng ứng dụng liệu pháp tế bào gốc trung mô trong điều trị đột quỵ
Tế bào gốc trung mô được đánh giá cao về tính an toàn và hiệu quả của liệu pháp tế bào gốc khi ứng dụng trên người trong điều trị bệnh đột quỵ.
Bảng: Các thử nghiệm lâm sàng trong điều trị đột quỵ bằng tế bào gốc trung mô
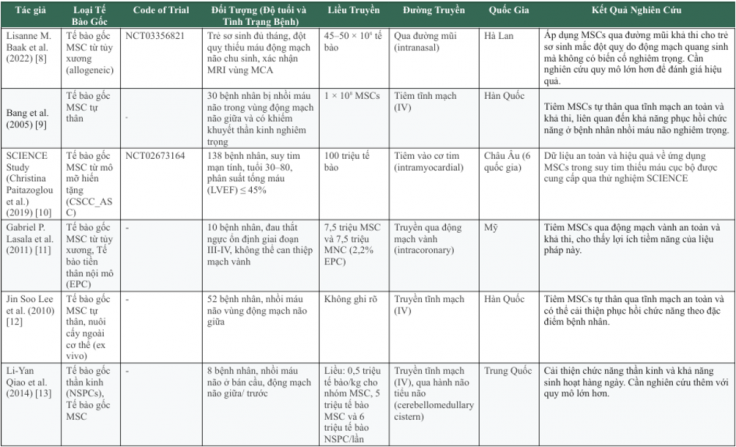
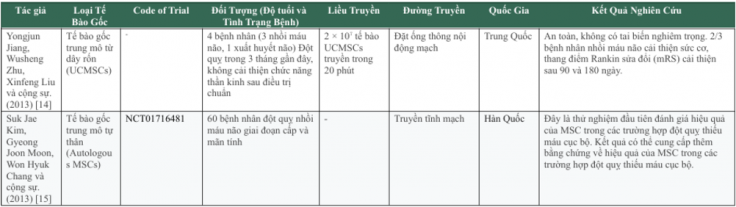
Thách thức trong việc sử dụng liệu pháp tế bào gốc để điều trị đột quỵ do thiếu máu cục bộ
Liệu pháp tế bào gốc mang lại nhiều triển vọng trong điều trị đột quỵ do thiếu máu cục bộ, nhưng vẫn còn nhiều thách thức cần vượt qua trước khi có thể áp dụng rộng rãi trong lâm sàng. Các thách thức này bao gồm việc theo dõi tế bào sau cấy ghép, tuổi thọ tế bào bị hạn chế, các vấn đề đạo đức, và nguy cơ về an toàn.
– Theo dõi tế bào cấy ghép
Các nhà khoa học đã phát triển nhiều kỹ thuật để theo dõi tế bào gốc sau khi cấy ghép vào cơ thể, bao gồm các phương pháp hình ảnh như chụp cắt lớp phát xạ positron (PET), chụp cắt lớp phát xạ đơn photon (SPECT/CT), hình ảnh phát quang sinh học (BLI) sử dụng protein GFP và chụp cộng hưởng từ (MRI) [17]. Ví dụ, Moshayedi và cộng sự đã sử dụng hydrogel acid hyaluronic (HA) để kéo dài sự sống của các tế bào cấy ghép trong ít nhất 6 tuần và theo dõi chúng trong cơ thể bằng MRI [18].
– Vấn đề đạo đức
Việc sử dụng một số loại tế bào gốc như tế bào gốc phôi (ESCs) và tế bào gốc thần kinh (NSCs) gây ra các tranh cãi đạo đức. Tế bào gốc cảm ứng vạn năng (iPSCs) là một giải pháp tiềm năng để khắc phục vấn đề này. Tuy nhiên, việc sản xuất iPSCs tự thân (lấy từ chính bệnh nhân) lại tốn kém và mất nhiều thời gian (vài tháng), gây cản trở việc áp dụng rộng rãi. Vì vậy, tế bào gốc trung mô (MSCs) được xem là nguồn tế bào tiềm năng cho các ứng dụng lâm sàng.
– Nguy cơ về an toàn
Liệu pháp tế bào gốc cũng tiềm ẩn nhiều nguy cơ về an toàn:
- Thải ghép miễn dịch: Các tế bào gốc từ người hiến (allogeneic) có thể bị hệ miễn dịch của người nhận từ chối.
- Hình thành khối u: Tế bào gốc phôi và iPSCs có thể phát triển thành các mô không mong muốn hoặc thậm chí gây ra khối u. Ví dụ, Erdö và cộng sự (2003) nhận thấy rằng việc lẫn tế bào gốc phôi chưa biệt hóa làm tăng nguy cơ hình thành khối u [19].
– Tối ưu hóa phác đồ điều trị
Cần thêm nhiều nghiên cứu để xác định phương pháp tốt nhất cho việc cấy ghép tế bào gốc, bao gồm thời điểm, đường truyền và liều lượng phù hợp. Nếu không có các phác đồ chuẩn hóa, rất khó để đạt được kết quả ổn định và an toàn.
Kết luận và triển vọng
Liệu pháp tế bào gốc là một hướng đi đầy hứa hẹn trong điều trị đột quỵ nhờ vào khả năng tái tạo mô, bảo vệ thần kinh, chống viêm và điều hòa miễn dịch. Tuy nhiên, để ứng dụng lâm sàng, cần giải quyết các vấn đề về nguồn tế bào, liều lượng, thời điểm cấy ghép và các tác dụng phụ. Kết hợp tế bào gốc với liệu pháp gen có thể mang lại hiệu quả tốt hơn trong các thử nghiệm lâm sàng tương lai.
Mặc dù còn tồn tại nhiều khó khăn chưa được giải quyết, các kết quả nghiên cứu cho thấy liệu pháp tế bào gốc có tiềm năng lớn trong việc cải thiện chất lượng cuộc sống của bệnh nhân đột quỵ.
- Yaqubi, S. and M. Karimian, Stem cell therapy as a promising approach for ischemic stroke treatment. Current Research in Pharmacology and Drug Discovery, 2024: p. 100183.
- Chung, J.-W., et al., Efficacy and safety of intravenous mesenchymal stem cells for ischemic stroke. Neurology, 2021. 96(7): p. e1012-e1023.
- Jaillard, A., et al., Autologous mesenchymal stem cells improve motor recovery in subacute ischemic stroke: a randomized clinical trial. Translational stroke research, 2020. 11: p. 910-923.
- de Celis-Ruiz, E., et al., Final results of allogeneic adipose tissue–derived mesenchymal stem cells in acute ischemic stroke (AMASCIS): A phase II, randomized, double-blind, placebo-controlled, single-center, pilot clinical trial. Cell transplantation, 2022. 31: p. 09636897221083863.
- Lee, J., et al., Efficacy of intravenous mesenchymal stem cells for motor recovery after ischemic stroke: a neuroimaging study. Stroke, 2022. 53(1): p. 20-28.
- Law, Z.K., et al., The effects of intravenous infusion of autologous mesenchymal stromal cells in patients with subacute middle cerebral artery infarct: a phase 2 randomized controlled trial on safety, tolerability and efficacy. Cytotherapy, 2021. 23(9): p. 833-840.
- Bang, O.Y., et al., Circulating extracellular vesicles in stroke patients treated with mesenchymal stem cells: a biomarker analysis of a randomized trial. Stroke, 2022. 53(7): p. 2276-2286.
- Baak, L.M., et al., Feasibility and safety of intranasally administered mesenchymal stromal cells after perinatal arterial ischaemic stroke in the Netherlands (PASSIoN): a first-in-human, open-label intervention study. The Lancet Neurology, 2022. 21(6): p. 528-536.
- Bang, O.Y., et al., Autologous mesenchymal stem cell transplantation in stroke patients. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society, 2005. 57(6): p. 874-882.
- Paitazoglou, C., et al., Rationale and design of the European multicentre study on Stem Cell therapy in IschEmic Non‐treatable Cardiac diseasE (SCIENCE). European Journal of Heart Failure, 2019. 21(8): p. 1032-1041.
- Lasala, G.P., et al., Combination stem cell therapy for the treatment of medically refractory coronary ischemia: a Phase I study. Cardiovascular Revascularization Medicine, 2011. 12(1): p. 29-34.
- Lee, J.S., et al., A long-term follow-up study of intravenous autologous mesenchymal stem cell transplantation in patients with ischemic stroke. Stem cells, 2010. 28(6): p. 1099-1106.
- Qiao, L.-y., et al., A two-year follow-up study of cotransplantation with neural stem/progenitor cells and mesenchymal stromal cells in ischemic stroke patients. Cell transplantation, 2014. 23(1_suppl): p. 65-72.
- Jiang, Y., et al., Feasibility of delivering mesenchymal stem cells via catheter to the proximal end of the lesion artery in patients with stroke in the territory of the middle cerebral artery. Cell Transplantation, 2013. 22(12): p. 2291-2298.
- Kim, S.J., et al., Intravenous transplantation of mesenchymal stem cells preconditioned with early phase stroke serum: current evidence and study protocol for a randomized trial. Trials, 2013. 14: p. 1-12.
- Florea, V., et al., Dose comparison study of allogeneic mesenchymal stem cells in patients with ischemic cardiomyopathy (the TRIDENT study). Circulation research, 2017. 121(11): p. 1279-1290.
- Zheng, Y., et al., Stem cell tracking technologies for neurological regenerative medicine purposes. Stem cells international, 2017. 2017(1): p. 2934149.
- Moshayedi, P., et al., Systematic optimization of an engineered hydrogel allows for selective control of human neural stem cell survival and differentiation after transplantation in the stroke brain. Biomaterials, 2016. 105: p. 145-155.
19. Erdö, F., et al., Host-dependent tumorigenesis of embryonic stem cell transplantation in experimental stroke. Journal of Cerebral Blood Flow & Metabolism, 2003. 23(7): p. 780-785.